湖南师范大学马元鸿教授课题组Org. Lett.:基于布朗斯特酸介导的C(sp2)−CN/C(sp2)−H偶联构建苯并[a]咔唑衍生物
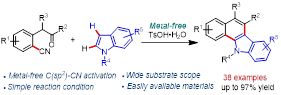
导读:近日,湖南师范大学马元鸿教授课题组报道了一种布朗斯特酸介导的C(sp2)–H键与羰基加成/C(sp2)−CN/C(sp2)−H键偶联的串联反应,成功合成了一系列苯并[a]咔唑衍生物。值得注意的是,该策略首次使用廉价的TsOH·H2O作为促进剂活化芳香C(sp2)−CN键,在无金属条件下实现了C(sp2)−CN/C(sp2)−H偶联。相关研究成果发表在Org. Lett.上(DOI: 10.1021/acs.orglett.2c01027)。
马元鸿教授简介

马元鸿,湖南师范大学教授,博士生导师,湖南省高层次计划人才。2008年和2011年分别于西北师范大学获得理学学士和硕士学位(导师:李政教授),2014年于四川大学有机化学专业获得理学博士学位(导师:游劲松教授)。2014年9月至2019年12月,先后在日本国立理化学研究所(合作导师:侯召民教授)和德国马克斯-普朗克煤炭研究所(合作导师:Josep Cornella博士)开展博士后研究。2020年1月全职加入湖南师范大学从事有机化学相关的教学与科研工作,2020年9月成立均相催化与合成课题组。近年来致力于金属有机化学、有机合成化学、有机功能分子合成等方面的前沿研究,现主持国家自然科学基金、湖南省自然科学基金和湖南省百人计划等科研和人才项目。截至目前,已经在Chem. Soc. Rev.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Org. Lett.、Chem. Eur. J等国际知名化学期刊发表论文20余篇。
C−C键的选择性活化及功能化是构造新的C−C或C−X(N、O 等)键的一种重要策略。在文献报道的众多C−C键活化的例子中,芳基腈的C(sp2)−CN键活化受到化学家们更多的关注,由于其相对便宜、稳定且商业来源广泛。然而,由于C(sp2)−CN键具有较高的键解离能(C6H5-CN = 132.3 ± 2.0 kcal/mol),这种转化在合成化学领域仍然是一个巨大的挑战。迄今为止,芳基腈的C(sp2)−CN键转化主要依赖于过渡金属催化剂,如Pd、Rh、Ni、Co和Fe等。基于此,过渡金属催化的芳基腈与有机金属试剂、芳基卤化物、胺、硼、硅、磷或其他试剂的交叉偶联反应已经取得巨大的进展(Scheme 1a)。近年来,科学家们发现在光催化或电催化条件下,带有吸电子基团的芳基腈或缺电子的杂芳基腈通过C(sp2)−CN键的断裂可产生相应的(杂)芳基自由基,从而发生一系列化学转化(Scheme 1b)。上述方法对过渡金属催化剂、昂贵的光催化剂和电化学设备的需求限制了这些策略的广泛应用。因此,发展一种无需光或电的协助的无金属作用的C(sp2)−CN键转化反应具有重要的科学意义和良好的应用前景。
此外,C(sp2)−CN/C(sp2)−H偶联是构建C−C键最有吸引力的策略之一,因为使用 C(sp2)−H键作为官能团避免了(杂)芳烃的预活化。然而,相关的研究还处于起步阶段,文献报到的零星例子仍然需要金属催化剂。本研究选择易得的2-(2-氧代-2-苯基乙基)-苄腈衍生物与吲哚为底物,以廉价的TsOH·H2O为促进剂,实现了一种布朗斯特酸介导的分子间C(sp2)−H与羰基加成和分子内的C(sp2)−CN/C(sp2)−H偶联的串联反应,为苯并[a]咔唑衍生物的合成提供了一种绿色、简便和高效的方法,其骨架广泛存在于天然产物、药物和有机功能材料分子中(Scheme 1c)。

(图片来源:Organic Letters)
首先,作者以2-(2-氧代-2-苯基乙基)-苄腈1a与1-甲基-1氢-吲哚2a为模板底物,对酸的种类、溶剂、温度、反应时间、底物的比例以及TsOH·H2O的用量等影响反应的关键因素进行深入的筛选,最终选择TsOH·H2O作为促进剂、甲苯为溶剂在120 °C下反应24 h为最佳反应条件,能够以89%的分离收率获得目标化合物3aa。随后,作者在最优条件下对该反应的底物适用范围进行了探究(Scheme 2),研究发现该反应体系对2-(2-氧代-2-芳基乙基)-苄腈衍生物和吲哚均有良好的适用性,烷基、三氟甲基、卤素原子、酯基、氰基和醚类等一系列重要的有机官能团可以很好的兼容,以中等到高的收率获得相应的苯并[a]咔唑衍生物,克级规模的实验也证明了方法在合成上的潜力。

(图片来源:Organic Letters)
此外,作者设计了一系列控制实验对反应机理进行了研究(SI and Scheme 3)。当吲哚的C2位被甲基取代时,1a与2t在120 °C反应仅生成3-烯基吲哚化合物5,产率为 85%,表明了吲哚C2−H键的必要性(Scheme 3a)。1a在标准条件下可以通过分子内环化转变为3-苯基-1氢-异香豆素-1-酮6和3-苯基异喹啉-1(2氢)-酮7(section 7.2 of SI)。随后,化合物6和7在标准条件下分别与吲哚2a反应,并没有观察到3aa,排除了化合物6或7作为反应的中间体的可能性。当反应的温度降低至65 oC时,反应生成了3-烯基吲哚8,产率为84% (Scheme 3b)。8可以在TsOH·H2O 为促进剂120 °C 的条件下进一步经历分子内的 C(sp2) −CN/C(sp2)−H偶联,得到苯并[a]咔唑化合物3aa,产率为92%(Scheme 3c)。在标准条件下未观察到2-甲基苄腈9与2a的分子间C(sp2) −CN/C(sp2)−H偶联(Scheme 3d)。此外,结构相似的带有F、Cl、Br、NO2和CO2H基团的1,2-二苯基乙基-1-酮11a-11e分别与2a反应,没有得到相应的产物3na (Scheme 3e),一定程度上排除了亲核芳香取代过程的可能性。上述实验结果清楚地表明了布朗斯特酸TsOH·H2O在该串联反应中发挥了至关重要的作用且3-烯基吲哚8是反应的活性中间体,该中间体通过TsOH·H2O介导的6π电环化过程得到苯并[a]咔唑产物3aa。

(图片来源:Organic Letters)
基于上述实验结果,作者以2-(2-氧代-2-苯基乙基)-苄腈1a与1-甲基-1氢-吲哚2a为底物,提出了可能的反应机理(Scheme 4)。首先,在TsOH·H2O存在下,2-(2-氧代-2-苯基乙基)苄腈 1a被质子化得到亲电物种I,然后被亲核试剂2a进攻形成物种II。随后物种II和III分别消除一分子的水和质子后,得到关键中间产物8。8在TsOH·H2O的作用下经6π电环化形成中间体IV。中间体IV和V经过C(sp2)−CN和C(sp2)−H键的裂解相继释放一分子的HCN或HNC和TsOH。最后,通过芳香性的重新构建产生产物3aa。

(图片来源:Organic Letters)
综上所述,通过使用商业可得且廉价的TsOH·H2O作为促进剂,作者开发了一种2-(2-氧代-2-苯基乙基)苄腈衍生物与吲哚参与的串联反应,该反应经历两个C(sp2)−H键和一个C(sp2)−CN键的断裂。该反应体系首次使用TsOH·H2O 作为促进剂实现了芳香C(sp2)−CN键的活化和无金属作用的C(sp2)−CN/C(sp2)−H偶联,反应体系具有广泛的底物适用范围和简单的条件,为苯并[a]咔唑衍生物的合成提供了一种绿色、高效的方法。
这一成果近期以“Cascade of C(sp2)−H Addition to Carbonyl and C(sp2)−CN/C(sp2)−H Coupling Enabled by Brønsted Acid: Construction of Benzo[a]carbazole Frameworks”为题发表于Organic Letters(DOI: 10.1021/acs.orglett.2c01027),该论文的第一作者为课题组研究助理唐玲(已被德国杜伊斯堡-埃森大学录取为博士研究生),通讯作者为马元鸿教授。上述研究工作得到了国家自然科学基金、湖南省自然科学基金和湖南师范大学特聘教授启动基金等项目的资助。